【两个至上2Firsts原创】11月21日,美国食品药品监督管理局(FDA) 发布了对电子烟上市前申请的审查的科学政策的13份备忘录,时间横跨2020年至 2023 年。FDA称这些备忘录描述了用于对调味电子烟和其他 PMTA 进行备案和审查的流程和优先级方法(详情:美国FDA发布13份监管科学政策备忘录:聚焦调味电子烟审查方法)。

针对本次发布的备忘录内容,2Firsts查阅相关资料并与多位合规专家交流发现, “年龄验证技术(Age gating technology)”的重要性被明确提出,即带有年龄验证的设备会获得优先审核。同时,部分备忘录也披露了FDA在后期审查中额外增加的对口味研究要求的这一细节。
具备年龄验证产品可获优先审查
一份名为“Filing Prioritization for PMTAs received between September 10, 2020 to November 3, 2021”的备忘录详细介绍了FDA对收到的预市场烟草产品申请(PMTAs)进行优先级排序的政策和背景。

在备忘录中,FDA解释了其审查优先级的核心原则,主要有以下两个方面:
- 递交日期为基础:通常按照PMTA的递交日期顺序进行审核。例如,9月10日递交的申请的产品将优先于9月15日递交产品的申请。
- 特殊优先事项:部分带有特殊技术或具有公共健康意义的申请可能会被优先处理。例如,备忘录中特别提到某公司提交了带有“年龄验证技术(age-gating technology)”的PMTA,因其潜在的公共健康影响而被优先处理。FDA表示“该申请被优先提交,因为它含有据称的年龄验证技术(The application was prioritized for Filing because it contains purported age-gating technology)。”

“备忘录展示了一个事实,带有“年龄验证(Age gating )”产品可以加速审查优先通过第二轮审核,直接进入第三阶段审核的内容。”2Firsts合规专家顾问Kurt说。
Kurt表示,“我的理解是 FDA 会优先审核年龄验证的产品,直接加速插队到第三阶段审核队列里,但是审核标准并没有降低。”
他也认为,从中也可以看出FDA的对电子烟的审查逻辑:增加年龄验证功能的设备能够有效避免青少年使用,因此被视为优先事项。
他表示,这类产品可能无需进行昂贵的随机对照试验 RCT 或长期队列研究 Longitudinal Cohort Study,因为其终端设备已经在青少年滥用方面起到了防控作用。
口味产品需证明“增量益处”
在另一份名为“ENDS Containing Non-Tobacco Flavored E-Liquid: Approach to PMTAs1 not in Substantive Scientific Review (Phase III)”的备忘录中,FDA讨论了非烟草口味电子烟(ENDS)的上市前烟草产品申请(PMTA)管理策略。
FDA在备忘录中,解释了自己的审查标准,该机构援引美国《联邦食品、药品和化妆品法案》(FD&C Act)的第910节,产品是否适合“保护公众健康”(APPH)是审查的关键,非烟草口味电子烟需要证明,相较于烟草口味的产品,其对成年吸烟者有“增量益处”(incremental benefit)。
“增量益处”可理解为FDA需要非烟草口味电子烟的提交者证明,相较于烟草口味产品或其他现有选择,对成年吸烟者提供了额外的好处,并且评估需要随机对照试验(RCT)或长期队列研究Longitudinal Cohort Study的证据。
如果缺乏上述研究的申请会被视为“致命缺陷”(fatal flaw),可能导致被下发营销拒绝令(MDO)。


Kurt表示,2021年7月起,FDA在审查流程中新增了对口味的长期临床测试要求。该额外要求导致大量企业被判定不合格,数千份市场拒绝令被下发给企业。后续这些企业因此对FDA提起了多起诉讼,认为此额外要求违背了PMTA最初的审核标准。
那FDA如何定义“非烟草口味”呢?
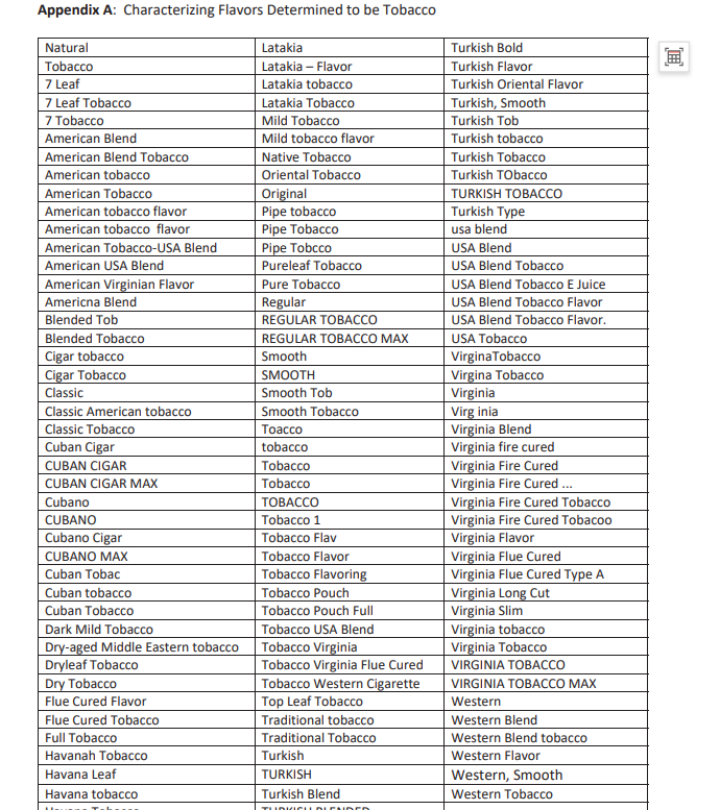
一份名为“Addendum to Approach to PMTAs1 for Non-Tobacco Flavored ENDS2 not in Substantive Scientific Review (Phase III)”的备忘录给出了解答,FDA在该分备忘录清单明确哪些产品属于非烟草口味,并定义“烟草”和“薄荷”口味的范围。
Kurt表示,这两份清单里的烟草口味和薄荷醇口味,是不会当作口味产品去进行审查的。只有FLAVOR SKU 是会被进行 fatal flaw长期临床试验审查,如果没有相关证据,FDA会对他们发送MDO信件。


这是 2024 年发布的第四批备忘录,FDA已累计发布26份监管科学政策备忘录。虽然FDA表示,发布的备忘录不应被用作准备申请或向 FDA 提交文件的工具、指南或手册。但是,对这些备忘录的分析和解读,仍有助于跟深入和准确的理解FDA对电子烟审查的理念和方法。
两个至上将持续关注美国电子烟监管政策最新动向。
关于本文,如果您对内容有任何补充意见、行业见解或相关信息,欢迎通过邮箱联系我们:info@2firsts.com。
欢迎向 2Firsts 提供相关线索、投稿、联系访谈或针对本文发表评论。
请联系:info@2firsts.com,或在 LinkedIn 上联系两个至上 2Firsts CEO 赵童(Alan Zhao)。
声明
1. 本文仅供专业研究用途,聚焦行业、技术与政策等相关内容。文中涉及的品牌与产品,仅为客观描述之目的,不构成对任何品牌或产品的认可、推荐或宣传。
2. 含尼古丁产品(包括但不限于卷烟、电子烟、加热烟草、尼古丁袋)具有显著健康风险。使用者须遵守其所在辖区的相关法律法规。
3. 本文不应作为任何投资决策或相关建议的依据。对于内容中的任何错误或不准确之处,2Firsts不承担直接或间接责任。
4. 未达到法定年龄的个人禁止访问或阅读本文。
版权声明
本文为2Firsts原创内容,或转载自第三方来源并已明确标注出处。其版权及使用权归2Firsts或原始版权所有方所有。任何个人或机构未经授权,不得复制、转载、分发或以其他形式使用本文内容,违者将依法追究法律责任。
如有版权相关事宜,请联系:info@2firsts.com
AI辅助声明
本文部分内容可能借助AI工具完成翻译或编辑,以提升效率。但由于技术限制,可能存在误差。建议读者参考原始来源以获取更准确的信息。
欢迎读者指出可能存在的问题,请联系:info@2firsts.com